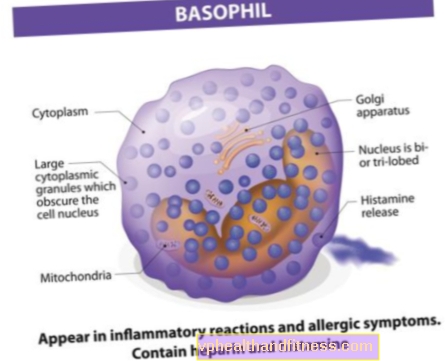
Клинические испытания - основа современной медицины. Они необходимы, чтобы проверить, является ли данное вещество в лекарстве безопасным, эффективным и лучше, чем доступно. Благодаря им можно узнать о новых и разработать существующие терапевтические стратегии, а также изучить знания об эффективности и безопасности лекарств. Прежде чем каждый препарат поступит в продажу, он должен пройти серию таких тестов.
Клинические испытания проводятся в нашей стране с начала 1990-х годов исследовательскими учреждениями, фондами и фармацевтическими компаниями. С началом клинических испытаний стали вводиться более высокие стандарты медицинского обслуживания и более современные и альтернативные методы лечения. Были созданы комитеты по биоэтике и Центральный регистр клинических исследований (CEBK), позже переименованный в Управление регистрации лекарственных средств, медицинских изделий и биоцидных материалов.
В целях защиты безопасности и прав людей, участвующих в клинических исследованиях, а также обеспечения надежности полученных данных были разработаны и внедрены правила надлежащей клинической практики (GCP). Это международные этические и научные стандарты планирования, проведения, документирования и отчетности о результатах исследований лекарственных средств у человека.
Чтобы начать исследование, в котором тестировщиками будут люди, необходимо подать заявление на получение разрешения президенту Управления регистрации лекарственных средств, медицинских устройств и биоцидных продуктов и в соответствующую комиссию по биоэтике. У президента Офиса есть 60 дней для принятия решения. Исследование может начаться только после согласия обоих властей. Клинические испытания обычно проводятся в больницах или медицинских исследовательских центрах.
- Они должны проводиться людьми с достаточно высокой профессиональной квалификацией, научными знаниями и опытом работы с пациентами, - говорит д-р Войцех Лущина, представитель Управления регистрации лекарственных средств, медицинских изделий и биоцидных продуктов.
Наибольшее количество новых препаратов в онкологииБольшинство клинических испытаний проводится в США и Западной Европе.
- В Польше количество зарегистрированных тестов остается стабильным на протяжении последних 10 лет - ежегодно проводится около 400-500 тестов. Более 20 процентов зарегистрированные исследования касаются онкологии. Другие области медицины, которые часто связаны с исследованиями, зарегистрированными в Польше, это: неврология, дерматология, гастроэнтерология, кардиология, диабетология, ревматология и пульмонология, - говорит Войцех Лющина. Президент Управления регистрации лекарственных средств, медицинских изделий и биоцидных материалов ведет Центральный регистр клинических испытаний (CEBK), в том числе информация об исследуемом лекарственном средстве, исследовательских сайтах и исследователях. - Однако этот реестр недоступен для общественности.
Однако существует общедоступный европейский реестр клинических испытаний, содержащий данные об исследованиях, проводимых в Европейском союзе, включая данные из Польши. Его можно найти на сайте www.clinicaltrialsregister.eu. Данные в реестре взяты из Европейской базы данных клинических исследований (EudraCT). Исследование появляется в реестре после внесения в базу данных информации о разрешении, выданном компетентным органом, и информации о положительном заключении соответствующего комитета по биоэтике, - добавляет Войцех Лущчина.
Также прочтите: Лечение рака: таргетная терапия с применением оружия для борьбы с раком Когда незастрахованный пациент может получить бесплатные услуги NHF? От идеи до аптеки. Как производятся лекарства?Прорывные открытия благодаря клиническим исследованиям
Благодаря клиническим испытаниям сегодня у нас есть много новых лекарств и методов лечения, и до недавнего времени неизлечимые заболевания можно успешно лечить. В 1999 г. только 3 из 10 пациентов с диагнозом лейкемия дожили до 5 лет. Сегодня во многих случаях лечение оказывается эффективным и не только останавливает прогрессирование заболевания, но и полностью излечивает пациента.
В свою очередь, благодаря разработке ингибиторов протеазы и последующим исследованиям по совершенствованию лекарств и методов лечения смертность среди пациентов со СПИДом снизилась на 70%. Благодаря новым препаратам пациенты после успешной трансплантации наслаждаются спасенной жизнью и обретают здоровье. В прошлом пациенты, которым требовалась трансплантация внутренних органов, не имели такой возможности, потому что иммунная система вызывала отторжение органов, пересаженных от неродственных доноров. Исследование оказалось эффективным и привело к почти полному устранению многих заболеваний, таких как болезнь Гейне-Медина (полиомиелит). 50 лет назад заражение этим заболеванием было связано с с высоким риском летального исхода или стойкого паралича мышц. Благодаря изобретению вакцины ее успешно сдерживают в большинстве регионов мира. Всемирная организация здравоохранения (ВОЗ) объявила в 2002 году, что Европа свободна от полиомиелита.
Четыре фазы клинических испытаний
Клинические испытания проводятся по строго определенным правилам. Большую роль играют здоровые и больные участники. Без них было бы невозможно определить, является ли данное лекарство эффективным и безопасным, поэтому не было бы возможности вводить все более и более эффективные лекарства. Поэтому крайне важно обеспечить безопасность волонтеров и уважение их прав. Клинические испытания разделены на 4 этапа, каждый из которых должен быть успешным, чтобы перейти к следующему этапу.
Первым этапом работы над веществом, которое будет использоваться в медицине, является доклинический этап исследования. Сначала соединение тестируется на клетках in vitro (выращенных вне живого организма в лабораторных условиях), а затем на экспериментальных животных. Такое исследование может занять до нескольких лет. По соображениям безопасности пациентов лекарство не может быть размещено на рынке исключительно на основании исследований, проведенных в лаборатории и на животных. Следовательно, необходимы исследования с участием подопытных пациентов.
Фаза I клинических испытаний
Поэтому следующий этап - это клинические испытания с участием здоровых людей (фаза I), цель которых - проверить или подтвердить предыдущие анализы и полученные знания. На первом этапе оценивается безопасность данного вещества, и несколько десятков здоровых добровольцев проверяют его абсорбцию, метаболизм, выведение и токсичность. Также проверяется взаимодействие веществ с пищей и часто употребляемыми лекарствами.
Результаты этой части работы помогают определить начальную дозировку. Испытания фазы I проводятся в исследовательских центрах, принадлежащих фармацевтическим компаниям или научным учреждениям. В случае исследований веществ для лечения рака и психических заболеваний фаза I объединяется с фазой II, чтобы не подвергать здоровых добровольцев воздействию высокотоксичных соединений.
Фаза II клинических испытаний
Целью клинических испытаний фазы II является определение того, работает ли новый препарат в определенной группе пациентов и является ли он безопасным. Также оценивается взаимосвязь между дозой и действием вещества, что приводит к определению дозы, используемой на последующих этапах исследования.
На данном этапе исследований влияние нового препарата и так называемого плацебо или лекарство, уже известное для лечения данного заболевания. В этой фазе исследования принимают участие несколько сотен добровольцев, страдающих тем или иным заболеванием.
Клинические испытания фазы III
На третьем этапе клинических испытаний, проводимых с участием нескольких тысяч пациентов, окончательно подтверждается, является ли исследуемый препарат эффективным при лечении данного заболевания. Целью этой части исследовательской работы является определение взаимосвязи между безопасностью вещества и эффективностью при краткосрочном и долгосрочном применении.
Эта часть исследования может занять от одного года до нескольких лет.
Фаза IV клинических испытаний
IV - последняя фаза клинических исследований касается зарегистрированных и продаваемых препаратов. Его цель - определить, безопасен ли препарат по всем показаниям, рекомендованным производителем, и для всех групп пациентов.
Клинические испытания - информация для пациента
Присоединение к клиническому исследованию является добровольным, однако требует соответствующей подготовки и размышлений. Врач, выступающий в роли исследователя, решает, соответствует ли человек медицинским критериям. По оценкам, ежегодно несколько тысяч польских пациентов дают свое информированное согласие на участие в клинических испытаниях новых лекарств. По оценкам Ассоциации надлежащей практики клинических исследований в Польше, на сегодняшний день в них могут принять участие около 200 000 человек. люди. Для некоторых пациентов это шанс начать современную терапию, улучшающую качество жизни. Помимо доступа к инновационным методам лечения, тщательно изучаются волонтеры. Нередко обнаруживаются заболевания, которые иначе не были бы обнаружены.
Стоит знать, что участник теста на наркотики имеет право на информацию о своем состоянии здоровья на каждом этапе исследования.
Любой доброволец, согласившийся участвовать в исследовании, может в любое время и по разным причинам отказаться от участия без каких-либо последствий. Он должен сообщить врачу о своем решении и пройти обследование, чтобы врач мог оценить его здоровье после участия в тестах.
Врач обязан сообщить участникам новые данные, которые могут, например, повлиять на решение о дальнейшем участии.
Участие в исследовании для пациента бесплатное. Спонсор исследования будет нести расходы на лекарства, специальные тесты и медицинское обслуживание, а также расходы на лечение побочных эффектов.
Безопасно ли участие в клинических испытаниях? Всегда есть риск
Клинические испытания проходят очень подробные процедуры и строгий контроль на каждом этапе. Это необходимо для того, чтобы снизить возможные риски, связанные с их проведением, для тех, кто в них участвует.
- При планировании клинического испытания следует сопоставить потенциальные риски и неудобства с ожидаемой пользой для участника испытания и для общества. Потенциальные выгоды для человека и общества в результате его проведения должны оправдывать риск, которому могут подвергнуться участники исследования, - говорит Войцех Лущина. Участники исследования в первую очередь подвержены возникновению побочных эффектов тестируемых препаратов или негативным последствиям процедур, связанных с проведенным тестом. Право на компенсацию имеют лица, у которых во время испытаний на наркотики необратимо ухудшилось здоровье.
Рекомендуемая статья:
Биологические препараты против биоподобных: это почти большая разницаИсточники:
https://pacjentwbadaniem.pl
https://www.badaniaklinicznewpolsce.pl/#/
Ассоциация надлежащей практики клинических исследований в Польше https://www.gcppl.org.pl